|
| Neuroimunologický ústav Slovenskej akadémie vied |
 |
845 10 Bratislava 45
Slovenská republika
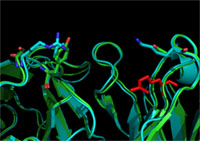
Výskumná skupina 1Proteín tau tvorí hlavnú zložku neurofibrilárnej patológie pri Alzheimerovej chorobe a príbuzných tauopátiách. V natívnom stave sa tau uplatňuje pri mnohých bunkových procesoch, kde zohráva dôležitú úlohu neusporiadaný charakter jeho molekuly. V podmienkach neurodegenerácie sa však rozpustná užitočná molekula mení na nerozpustné klbká, ktoré sú sprievodným znakom postihnutých neurónov a pravdepodobným pôvodcom ich smrti. Na objasnenie mechanizmu premeny ne usporiadaného tau na zle usporiadané klbko sa sústreďuje pozornosť najlepších vedeckých tímov pracujúcich v tejto oblasti. Ako však zachytiť efemérne formy fexibilnej molekuly, ktoré predchádzajú patologickému zlomu?
V našom laboratóriu sme vyvinuli súbor nových biofyzikálnych a kryštalografických prístupov, ktoré umožňujú komplemetárne opísať a charakterizovať konformáciu proteínu tau v natívnom stave, pri jeho patologickej transformácii a v podmienkach patologického foldingu. Pri štúdiu využívame rekombinantné formy proteínu tau a špecifické monoklónové protilátky z hybridomovej banky ústavu. Na charakterizáciu štruktúry tau je využívaná technika rezonancie povrchového plazmónu, analytická chromatografia, biochemické a imunochemické postupy, kryštalografické metódy ako aj hmotnostná spektrometria. Spolupracujeme s centrami štruktúrnej biológie SAV (Ústav molekulárnej biológie), AV ČR (Ústav molekulární genetiky), Max Perutz laboratóriami vo Viedni a synchrotronovými pracoviskami vo Švajčiarsku a Nemecku. Sme lídrami v oblasti využitia špecifických monoklónových protilátok pre štúdium štruktúry proteínu tau na atomovej úrovni.
Pre záujemcov o nástup na dennú formu doktorandského štúdia od 1.9.2009 vypisujeme nasledovné témy dizertačných prác:
Školiteľ: RNDr. Rostislav Škrabana, PhD. Úspešní uchádzači budú mať možnosť nadpriemerných pracovných podmienok prostredníctvom participácie na domácich a medzinárodných grantoch. Účasť na našich projektoch je otvorená aj pre motivovaných záujemcov z radov vysokoškolských študentov magisterského štúdia, ktorí sa môžu uchádzať o vypracovanie diplomovej práce v našom laboratóriu. Publikácie
|
||
| © 2026 NIU SAV / niluwebs@savba.sk |